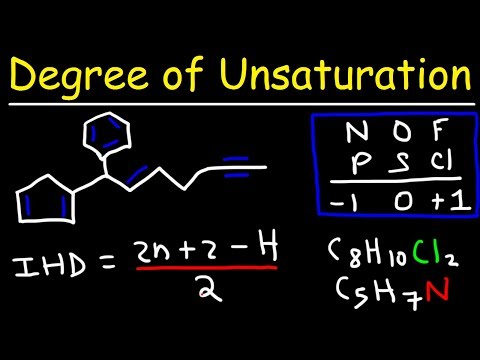
I analysen af organiske molekylers molekylformel er graden af umættethed en beregning, der bestemmer det samlede antal ringe og π-bindinger. En formel bruges i organisk kemi til at hjælpe med at tegne kemiske strukturer.
Hvordan finder du graden af umættethed?
Beregning af umættethedsgrad (DU) [2C+2=(2x3)+2=8.] Forbindelsen har brug for 4 hydrogener mere for at være fuldt mættet (forventet antal hydrogener-observeret antal hydrogener=8-4=4). Grader af umættethed er lig med 2 eller halvdelen af antallet af hydrogener, molekylet skal klassificeres som mættet.
Hvad er graden af umættethed i organisk kemi?
I analysen af den molekylære formel for organiske molekyler er graden af umættethed (også kendt som indekset for brintmangel (IHD), dobbeltbindingsækvivalenter eller umættethedsindeks) en beregning, der bestemmer det samlede antal ringe og π-bindinger. …
Hvad betyder graden af umættethed på 4?
Eksempel: benzen (4 grader af umættethed)
For eksempel, således den molekylære formel C6H 6 (4 grader af umættethed) er opfyldt af molekyler med. 4 pi-bindinger. 3 pi-bindinger og en ring (benzen) to pi-bindinger og to ringe (den meget ustabile Dewar-benzen, syntetiseret i 1963)
Hvad betyder en grad af umættethed på 1/2?
En grad af umættethed svarer til 1 ring eller 1 dobbeltbinding (1 π-binding). To grader af umættethed svarer til 2 dobbeltbindinger, 1 ring og 1 dobbeltbinding, 2 ringe eller 1 tripelbinding (2 π-bindinger).